Réf : NEURONE.be, 05 Juillet 2023
Quelles perspectives de prévention pour le d-gamma-tocophérol (vitamine E naturelle) dans le vieillissement cérébral normal et pathologique?
Résumé
Un modèle murin de vieillissement d’origine environnementale est proposé avec des animaux exposés à des micro-ondes leur vie durant et montrant en fin d’existence une altération de leurs capacités mnésiques ainsi qu’une mortalité double de celle des animaux d’un groupe témoin. Ces résultats sont expliqués par les conséquences au niveau neuronal d’une aggravation progressive de la rupture de la barrière hémato-encéphalique (BHE). Ces altérations sont comparées au dérèglement continu de la perméabilité de la BHE avec l’âge dans le cerveau humain et suggérent un état pathophysiologique possible de la vieillesse. Un traitement des troubles de la sénescence cérébrale par la vitamine E naturelle est proposé en rapport avec les propriétés antioxydantes spécifiques de son composant d-gamma-tocophérol sur le mécanisme d’ouverture de la BHE.
Introduction
Comme tous les organes, le cerveau subit les effets de l’âge. Ces altérations sont plus ou moins marquées suivant les structures. On trouve des changements particulièrement dans les circuits de la mémoire lesquels s’inscrivent dans une réorganisation continue englobant la mort neuronale (1).
Le vieillissement est un phénomène dont les causes sont encore mal connues mais dont le processus peut être hâté sous l’action d’éléments extérieurs, tel qu’un environnement nocif (2).
S’il est un type d’exposition environnementale occupant actuellement tous les territoires de vie, c’est celui des champs électromagnétiques. Quelle que soit son intensité, personne n’y échappe. Sur cette base, un modèle de vieillissement expérimental utilisant les effets des micro-ondes chez l’animal a été utilisé, dont les caractéristiques peuvent être extrapolables à l’homme en vue d’une action thérapeutique.
Effets des micro-ondes sur le cerveau du rat, un modèle de vieillissement
Il ressort de plusieurs expérimentations effectuées par différents groupes (3,4) qu’une exposition à des micro-ondes de 900 MHz - correspondant à l’émission de téléphones portables de type GSM - à raison de 2-3 heures par jour pendant 28 jours a provoqué des troubles significatifs de la mémoire chez le rat, endommagé la perméabilité de la BHE au niveau de l’hippocampe et du cortex, et créé un œdème cellulaire associé à une dégénérescence neuronale.
Les conditions expérimentales de ces tests se limitant à un essai à court terme, l’observation des effets chroniques d’une exposition aux micro-ondes s’imposait dans la perspective d’une comparaison avec les conditions habituelles d’existence de l’homme moderne.
Des rats ont ainsi été exposés deux heures par jour pendant presque toute la durée de leur vie à des doses de micro-ondes reflétant celles que rencontrent une majorité de personnes et les effets éventuels comparés à un groupe témoin de rats non-exposés. Une augmentation de la mortalité dans le groupe exposé fut observée après 21 mois. Cette mortalité a connu une augmentation constante jusqu’à atteindre, à l’âge de 28 mois, le double de celle des animaux dans le groupe témoin (5).
En parallèle avec l’étude précitée, ont été examinés les effets d’une exposition à des micro-ondes de 970 MHz, qui sont celles d’un GSM, sur la mémoire de rats soumis à un protocole de reconnaissance d’objets et les effets comparés aux animaux d’un groupe témoin non-exposé. Si, après deux mois, aucune anomalie n’a été constatée, les animaux du groupe exposé pendant 15 mois ont montré un comportement déviant ne réussissant plus à faire la distinction entre un objet familier et un objet étranger (6).
Ces résultats reflètent typiquement un syndrome de vieillissement.
En corollaire des observations en aigu, les résultats de ces études effectuées en mode chronique peuvent s’interpréter comme les effets des micro-ondes sur la BHE (figure 1)
Jacques Lintermans, Docteur en sciences et André Vander Vorst, Professeur ém. UCLouvain
Résumé
Un modèle murin de vieillissement d’origine environnementale est proposé avec des animaux exposés à des micro-ondes leur vie durant et montrant en fin d’existence une altération de leurs capacités mnésiques ainsi qu’une mortalité double de celle des animaux d’un groupe témoin. Ces résultats sont expliqués par les conséquences au niveau neuronal d’une aggravation progressive de la rupture de la barrière hémato-encéphalique (BHE). Ces altérations sont comparées au dérèglement continu de la perméabilité de la BHE avec l’âge dans le cerveau humain et suggérent un état pathophysiologique possible de la vieillesse. Un traitement des troubles de la sénescence cérébrale par la vitamine E naturelle est proposé en rapport avec les propriétés antioxydantes spécifiques de son composant d-gamma-tocophérol sur le mécanisme d’ouverture de la BHE.
Introduction
Comme tous les organes, le cerveau subit les effets de l’âge. Ces altérations sont plus ou moins marquées suivant les structures. On trouve des changements particulièrement dans les circuits de la mémoire lesquels s’inscrivent dans une réorganisation continue englobant la mort neuronale (1).
Le vieillissement est un phénomène dont les causes sont encore mal connues mais dont le processus peut être hâté sous l’action d’éléments extérieurs, tel qu’un environnement nocif (2).
S’il est un type d’exposition environnementale occupant actuellement tous les territoires de vie, c’est celui des champs électromagnétiques. Quelle que soit son intensité, personne n’y échappe. Sur cette base, un modèle de vieillissement expérimental utilisant les effets des micro-ondes chez l’animal a été utilisé, dont les caractéristiques peuvent être extrapolables à l’homme en vue d’une action thérapeutique.
Effets des micro-ondes sur le cerveau du rat, un modèle de vieillissement
Il ressort de plusieurs expérimentations effectuées par différents groupes (3,4) qu’une exposition à des micro-ondes de 900 MHz - correspondant à l’émission de téléphones portables de type GSM - à raison de 2-3 heures par jour pendant 28 jours a provoqué des troubles significatifs de la mémoire chez le rat, endommagé la perméabilité de la BHE au niveau de l’hippocampe et du cortex, et créé un œdème cellulaire associé à une dégénérescence neuronale.
Les conditions expérimentales de ces tests se limitant à un essai à court terme, l’observation des effets chroniques d’une exposition aux micro-ondes s’imposait dans la perspective d’une comparaison avec les conditions habituelles d’existence de l’homme moderne.
Des rats ont ainsi été exposés deux heures par jour pendant presque toute la durée de leur vie à des doses de micro-ondes reflétant celles que rencontrent une majorité de personnes et les effets éventuels comparés à un groupe témoin de rats non-exposés. Une augmentation de la mortalité dans le groupe exposé fut observée après 21 mois. Cette mortalité a connu une augmentation constante jusqu’à atteindre, à l’âge de 28 mois, le double de celle des animaux dans le groupe témoin (5).
En parallèle avec l’étude précitée, ont été examinés les effets d’une exposition à des micro-ondes de 970 MHz, qui sont celles d’un GSM, sur la mémoire de rats soumis à un protocole de reconnaissance d’objets et les effets comparés aux animaux d’un groupe témoin non-exposé. Si, après deux mois, aucune anomalie n’a été constatée, les animaux du groupe exposé pendant 15 mois ont montré un comportement déviant ne réussissant plus à faire la distinction entre un objet familier et un objet étranger (6).
Ces résultats reflètent typiquement un syndrome de vieillissement.
En corollaire des observations en aigu, les résultats de ces études effectuées en mode chronique peuvent s’interpréter comme les effets des micro-ondes sur la BHE (figure 1)
Figure 1 : Barrière Hémato-Encéphalique
Cerveau de la personne âgée et altération de la barrière hémato-encéphalique
Les changements morphologiques et biochimiques du cerveau âgé sont l’objet d’une recherche intensive depuis de nombreuses années. Cependant, le rôle crucial de l’altération et de la rupture de la BHE fait depuis récemment l’objet d’une attention spéciale. La BHE limite l’entrée des composés sanguins, ainsi que de produits pathogènes dans le cerveau et joue un rôle essentiel dans le fonctionnement neuronal normal.
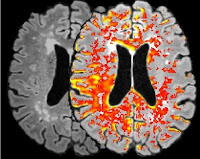
Une analyse tissulaire post-mortem ainsi qu’une imagerie obtenue par résonance magnétique nucléaire a permis de quantifier la perméabilité de la BHE dans le cerveau humain. Une étude portant sur des sujets âgés de 21 à 83 ans a mis en évidence une augmentation linéaire de la perméabilité de la BHE en fonction de l’âge, à 60 ans presque la moitié de la population étant affectée par une rupture de la BHE (7). (Figure 2)*
*Figure 2: MRI-scan images of the blood-brain-barrier leakage. Maastricht University, News & Events, 1st of June 2016
Ces altérations observées chez l’homme sont semblables à celles provoquant un vieillissement chez le rat, postulant un mécanisme commun contribuant aux troubles de la sénescence.
Mécanisme d’action de la barrière hémato-encéphalique
Une description fonctionnelle actuellement acceptée de la BHE consiste en une régularisation par les métalloproteinases de la matrice protéique qui la compose. Ces enzymes sont stimulées par le peroxynitrite (PN) lequel peut être produit en excès par les micro-ondes ou dans des conditions de stress oxydant (8) provoquant ainsi l’ouverture de la barrière hémato-encéphalique.
Vitamine E et dysfonctionnement de la barrière hémato-encéphalique
Peu de produits actifs existent en pharmacologie ayant des propriétés protectrices au niveau de la BHE. Une action sur le PN semble tout indiquée pour freiner le mécanisme ci-dessus et ainsi s’opposer à l’ouverture pathologique de la BHE.
Chimiquement, le PN se caractérise par la présence d’un atome d’oxygène réactif responsable de réactions biologiques oxydatives. Le PN est donc une cible de choix pour les médicaments potentiellement dotés de propriétés anti-oxydantes.
Une condition d’efficacité d’une substance dépend de sa biodisponibilité au niveau de l’organe cible qu’elle doit atteindre en concentration utile.
Cet aspect du problème introduit l’intérêt pour la vitamine E. Celle-ci est composée de 8 molécules optiquement actives dextrogyres l’atome de carbone vicinal de l’oxygène dans l’hétérocycle étant asymétrique, dont 4 appartenant au groupe des tocophérols. Leurs structures sont voisines, leur dénomination en alpha, beta, gamma, delta répondant à une différence entre le nombre et la position de groupes méthyle sur le noyau benzène de la molécule (voir tableau, figure 3)*.
Le d-alpha-tocophérol est souvent indistinctement appelé vitamine E. La vitamine E a des propriétés anti-oxydantes bien connues et largement exploitées dans le domaine des produits alimentaires.
Quel rapport avec la BHE ?
C’est tout d’abord la structure chimique des molécules de la vitamine E qui comportent d’une part une longue chaîne aliphatique dont la liposolubilité facilite le contact avec l’endothélium de la BHE, et d’autre part un groupement phénolique exerçant une action neutralisante sur l’oxygène actif. De plus, la vitamine E est une composante structurelle de la membrane cellulaire.
Parmi les composants de la vitamine E, le d-gamma-tocophérol est spécifiquement actif pour neutraliser le peroxinitrite (10), ce qui s’explique stériquement par l’absence de groupe méthyle en position vicinale du groupe hydroxyle, offrant ainsi plus d’espace à son action.
Ceci pointe aussi l’importance d’utiliser de la vitamine E naturelle au lieu de la mono molécule dl-alpha-tocophérol qui est un produit racémique obtenu par synthèse et qui est couramment présenté sur le marché pharmaceutique comme la vitamine E. Bien qu’étant le plus largement prescrit, ce produit synthétique est biologiquement moins actif que le produit naturel car composé pour moitié de l’énantiomère «l» qui n’a pas d’utilité physiologique reconnue et est doté d’une biodisponibilité significativement plus faible (11).
Résultats expérimentaux des effets de la vitamine E sur la barrière hémato-encéphalique
Les effets protecteurs de la vitamine E sur la BHE ont été montrés chez le rat âgé en état de convulsions provoquées par le pentylènetétrazol (12).
Ce modèle d’épilepsie expérimentale comporte une composante pathologique sous forme d’augmentation considérable de la perméabilité de la BHE.
Il a été montré que cette augmentation était significativement réduite par la vitamine E.
Ces résultats apportent une preuve que la vitamine E est active sur la BHE dans des conditions provoquant sa rupture.
Perspectives cliniques
Si d’un point de vue clinique la vieillesse n’est pas considérée comme une maladie, les dérèglements qui l’accompagnent au niveau cérébral peuvent se manifester d’abord par des troubles cognitifs légers, pouvant s’aggraver jusqu’à devenir pathologiques. Plusieurs pathologies neurodégénératives sont associées à un stress oxydatif lequel se manifeste par une peroxydation des lipides, une oxydation des protéines et la présence d’autres marqueurs (13). Parmi les maladies dans la pathogenèse desquelles un stress oxydatif est considéré comme jouant un rôle important se trouvent la maladie d’Alzheimer (MA) et la maladie de Parkinson (MP) (14).
Le cerveau contient des hauts niveaux de lipides oxydables qui doivent être protégés par des antioxydants. Des concentrations faibles de vitamine E, quantitativement l’antioxydant lipophile majeur dans le cerveau, ont été fréquemment observées dans le liquide cérébrospinal de patients MA, suggérant qu’un traitement avec des compléments alimentaires pourrait retarder le développement de la MA (15).
Ce concept est en accord avec les résultats d’une étude clinique contrôlée avec placebo, effectuée avec de la vitamine E (2000 UI, pendant 2 ans) et montrant un ralenti (-53%) de la détérioration fonctionnelle de patients atteints de MA modérée (16).
A ce jour, de nombreuses études cliniques ont été effectuées avec la vitamine E sur les maladies neurodégénératives avec des résultats controversés. Ces variations sont explicables par les différences de durée de traitement, courtes dans le cas d’études cliniques, longues dans le cas d’observation des effets de la vitamine E alimentaire ou en compléments, ainsi que par les doses administrées. Par exemple dans une étude sur patients MA (17) la taille de l’échantillon était très petite et la dose de vitamine E comportait 800 UI)/jour pendant une durée de 6 mois alors que dans d’autres études les doses étaient 2000 UI en prise quotidienne pendant 2 ou 3 ans.
Les différences entre les types de vitamine E administrée - racémique, tocophérol monomoléculaire, naturelle – peuvent aussi expliquer les différences de résultat (18) comme, par exemple, celui d’une étude ayant conclu à l’absence de bénéfice de la vitamine E sur le déficit cognitif léger de patients MA. L’analyse de cette étude (19) pointe le fait qu’elle examine les effets d’un complément composé uniquement d’alpha-tocophérol, dont le gamma-tocophérol est donc absent.
Or, le gamma-tocophérol a été trouvé plus efficace dans la capture de radicaux libres et de nitrogènes oxygénés qui sont des composants des pathologies neurodégénératives.
De plus, il est observé que l’usage d’un complément d’alpha-tocophérol peut réduire significativement le taux de gamma-tocophérol physiologique dans le sérum sanguin ceci pouvant entrainer d’importants effets biologiques.
Il en ressort que les effets bénéfiques sur la santé attendus d’un complément d’alpha-tocophérol peuvent être supprimés par des changements délétères dans la biodisponibilité d’autres formes plus actives de tocophérols, cette situation comptant parmi les raisons pouvant expliquer l’absence d’effet d’une supplémentation en alpha-tocophérol sur les troubles cognitifs légers de patients MA.
Une étude a montré que le gamma-tocophérol réduisait plus fortement le stress nitrosatif (c’est à dire relatif au peroxynitrite) dans le cerveau que l’alpha-tocophérol (20).
Dans une autre étude, il s’est avéré qu’une augmentation de la prise d’un mélange de tocophérols à partir de la nourriture allait de pair avec un risque plus faible de problèmes cognitifs que la prise d’alpha-tocophérol seul (21).
En outre, le gamma-tocophérol réduisait le risque de démence Alzheimer plus fort que l’alpha-tocophérol : la prise de 5 mg d’alpha-tocophérol par jour faisait baisser le risque d’Alzheimer de 34 %, celle de gamma-tocophérol de 40%.
Les répercussions des deux tocophérols sur la neuropathologie d’Alzheimer sont complexes, mais le gamma-tocophérol semble y jouer un rôle déterminant.
Un traitement de la maladie de Parkinson par la vitamine E fait l’objet d’intérêt depuis de nombreuses années. Si, au contraire de la Sélégiline qui est un inhibiteur de la monoamineoxydase (IMAO) la vitamine E s’est montrée inactive chez le rat sur l’activité des neurones dopaminergiques nigrostriataux (22), son mécanisme d’action comme antioxydant a orienté les recherches qui la concernent vers les aspects vasculaires de la MP auxquels il est porté de plus en plus d’attention. Un dysfonctionnement endothélial a été impliqué comme évènement crucial de plusieurs troubles du système nerveux central, dont la maladie de Parkinson (23). Une étude clinique en double aveugle a montré que la vitamine E, associée à l’oméga-3, améliorait significativement tous les paramètres d’évaluation de sévérité de la maladie de Parkinson (24).
En rapport avec l’objet du présent article, il a été montré que la barrière-hémato-encéphalique présentait des ruptures dans les régions du cerveau impliquées dans la pathophysiologie de la maladie de Parkinson (25). Cette constatation suggère une approche thérapeutique possible par la vitamine E, en tenant compte des conditions spécifiées pour la maladie d’Alzheimer.
Conclusion
Les effets des micro-ondes chez l’animal présentent des caractéristiques répondant à la description d’une détérioration de la fonction cérébrale. Appliqués à l’homme âgé, ils s’identifient aux symptômes d’un vieillissement. Ces observations sont expliquées par les conséquences au niveau neuronal de l’augmentation de la rupture progressive de la barrière-hémato-encéphalique.
Une perspective de traitement par la vitamine E naturelle est suggérée en rapport avec les propriétés antioxydantes spécifiques de son composant d-gamma-tocophérol sur le mécanisme d’ouverture de la BHE, pouvant ralentir les troubles de la sénescence à leur début.
Références
(1) Costa e Silva J. Vieillissement cérébral, aspects biologiques et psychosociaux. Académie Nationale de Médecine, Communication scientifique, Séance du 11 octobre 2005
(2) Brown R., Lockwood A., Sonawane B. Neurodegenerative Diseases: An Overview of Environmental Risk Factors. Environmental Health Perspectives 2005; 113(9): 1250-1256
(3) Jun Tang, Yuan Zhang, Liming Yang et al. Exposure to 900 MHz electromagnetic fields activates the mkp-1/ERK pathway and causes blood-brain barrier damage and cognitive impairment in rats. Brain Research 2015; 1601: 92-101
(4) Eberhardt J., Bertil R., Person R. et al. Blood-brain barrier permeability and Nerve cell damage in rat brain 14 and 28 days after exposure to microwaves from GSM mobile phones .Electromagnetic Biology and Medicine 2008; 27(3): 215-229
(5) Adang D., Remacle C., Vander Vorst A. Results of a long-term low-level microwave exposure of rats IEE Transactions on Microwave Theory and Techniques 2009; 57(10): 2488-2497
(6) Adang D., Campo B., Vander Vorst A. Has a 970 MHz pulsed exposure an effect on the memory related behavior of rats? Proceedings of the 9th European Conference in Wireless Technology, 2-9600551-5-2 C 2006 EuMA, September 2006, Manchester UK, pp.135-13
7) Van de Haar H., Burgmans S., Jansen J. et al. Blood-Brain Barrier Leakage in Patients with early Alzheimer Disease. Radiology 2016; 281(2): 527-535
(8) Suofu Y. et al., Peroxynitrite decomposition catalyst prevents MMP activation and neurovascular injury after prolonged cerebral ischemia in rats. J Neurochem. 2010; 115(5): 1266-1276
(9) Rempe R. G., Hatz A. M. S., Bauer B., Matrix metalloproteinases in the brain and blood-brain barrier: Versatile breakers and makers. J Cereb Blood Flow Metab. 2016; 36(9): 1481-1507
(10) Traber M.G., Utilization of Vitamin E. Biofactors (Oxford, England), 01 Jan 1999; 10(2-3): 115-120
(11) Jiang Q. et al. Gamma tocopherol, the major form of vitamin E in the US diet, deserves more attention. Am J Clin Nut. 2001; 74: 714-22
(12) Yorulmaz H., Seker F.B., Oztas B. Effect of Vitamin E on Blood-Brain Barrier Permeability in Aged Rats with PTZ-Induced Convulsions. Neurophysiology 2011; 42: 349-353
(13) Markesbery W., Carney J. Oxidative alterations in Alzheimer’s disease. Brain Pathology. 1999; 9(1): 133-146
(14) Butterfield A., Castagna A., Drake J. Vitamin E and neurodegenerative disorders associated with oxidative stress. Nutritional Neuroscience 2002; 5(4): 229-239
(15) Kontush A. et Schekatolina S. Vitamin E in Neurodegenerative disorders: Alzheimer’s disease. Annals of the New York Academy of Sciences 2004; 1031(1): 249-262
(16) Sano M., Ernesto Ch., Thomas R. et al. A controlled trial of Selegiline,alpha-tocopherol,or both as treatment for Alzheimer’s disease. N Engl J Med. 1997; 336: 1216-22
(17) Lloret A., Badia MC., Mora N. et al. Vitamin E paradox in Alzheimer’s disease: It does not prevent loss of cognition and may even be detrimental. J Alzheimers Dis. 2009; 17(1): 143-149
(18) Brewer G. Why vitamin E therapy fails for treatment of Alzheimer disease. J Alzheimers Dis. 2010; 19(1): 27-30
(19) Owoedimo B., Ugoro & Shaker A., Mousa. Vitamin E forms in Alzheimer’s disease: a review of controversial and clinical experiences. Critical Reviews in Food Science and Nutrition 2010; 50(5): 414-419
(20) Williamson K., Gabbita S., Mou S. et al. The nitration product 5-nitro-gamma-tocopherol is increased in the Alzheimer Brain. Nitric Oxide. 2002; 6(2): 221-227
(21) Morris M., Evans D., Bienas J. et al. Vitamin E and cognitive decline in older persons. Arch Neurol. 2002; 59(7): 1125-1132
(22) Miklya I., Knoll B., Knoll J. A pharmacological analysis elucidating why, in contrast to (-)-deprenyl (Selegiline), alpha-tocopherol was ineffective in the DATATOP study. Life Sciences 2003; 72(23): 2641-2648
(23) Grammas P., Martinez J., Miller B. Cerebral microvascular endothelium and the pathogenesis of neurodegenerative diseases. Expert Rev.Mol.Med. 2011; 13: e19
(24) Taghizadeh M., Tamtaji O., Dagostar F. et al. The effects of omega-3 fatty acids and vitamin E co-supplementation on clinical and metabolic status in patients with Parkinson’s disease: A randomized, double-blind, placebo-controlled trial. Neurochemistry International 2017; 108: 183-189
(25) Al-Bachari S., Naish J., Parker G. et al. Blood-brain-barrier leakage is increased in Parkinson’s disease. Front.Physiol. 2020; 11: 593026
Les changements morphologiques et biochimiques du cerveau âgé sont l’objet d’une recherche intensive depuis de nombreuses années. Cependant, le rôle crucial de l’altération et de la rupture de la BHE fait depuis récemment l’objet d’une attention spéciale. La BHE limite l’entrée des composés sanguins, ainsi que de produits pathogènes dans le cerveau et joue un rôle essentiel dans le fonctionnement neuronal normal.
Une analyse tissulaire post-mortem ainsi qu’une imagerie obtenue par résonance magnétique nucléaire a permis de quantifier la perméabilité de la BHE dans le cerveau humain. Une étude portant sur des sujets âgés de 21 à 83 ans a mis en évidence une augmentation linéaire de la perméabilité de la BHE en fonction de l’âge, à 60 ans presque la moitié de la population étant affectée par une rupture de la BHE (7). (Figure 2)*
*Figure 2: MRI-scan images of the blood-brain-barrier leakage. Maastricht University, News & Events, 1st of June 2016
Ces altérations observées chez l’homme sont semblables à celles provoquant un vieillissement chez le rat, postulant un mécanisme commun contribuant aux troubles de la sénescence.
Mécanisme d’action de la barrière hémato-encéphalique
Une description fonctionnelle actuellement acceptée de la BHE consiste en une régularisation par les métalloproteinases de la matrice protéique qui la compose. Ces enzymes sont stimulées par le peroxynitrite (PN) lequel peut être produit en excès par les micro-ondes ou dans des conditions de stress oxydant (8) provoquant ainsi l’ouverture de la barrière hémato-encéphalique.
Vitamine E et dysfonctionnement de la barrière hémato-encéphalique
Peu de produits actifs existent en pharmacologie ayant des propriétés protectrices au niveau de la BHE. Une action sur le PN semble tout indiquée pour freiner le mécanisme ci-dessus et ainsi s’opposer à l’ouverture pathologique de la BHE.
Chimiquement, le PN se caractérise par la présence d’un atome d’oxygène réactif responsable de réactions biologiques oxydatives. Le PN est donc une cible de choix pour les médicaments potentiellement dotés de propriétés anti-oxydantes.
Une condition d’efficacité d’une substance dépend de sa biodisponibilité au niveau de l’organe cible qu’elle doit atteindre en concentration utile.
Cet aspect du problème introduit l’intérêt pour la vitamine E. Celle-ci est composée de 8 molécules optiquement actives dextrogyres l’atome de carbone vicinal de l’oxygène dans l’hétérocycle étant asymétrique, dont 4 appartenant au groupe des tocophérols. Leurs structures sont voisines, leur dénomination en alpha, beta, gamma, delta répondant à une différence entre le nombre et la position de groupes méthyle sur le noyau benzène de la molécule (voir tableau, figure 3)*.
Le d-alpha-tocophérol est souvent indistinctement appelé vitamine E. La vitamine E a des propriétés anti-oxydantes bien connues et largement exploitées dans le domaine des produits alimentaires.
Figure 3
* Droits
de reproduction acquis sous licence chez ALAMY
C’est tout d’abord la structure chimique des molécules de la vitamine E qui comportent d’une part une longue chaîne aliphatique dont la liposolubilité facilite le contact avec l’endothélium de la BHE, et d’autre part un groupement phénolique exerçant une action neutralisante sur l’oxygène actif. De plus, la vitamine E est une composante structurelle de la membrane cellulaire.
Parmi les composants de la vitamine E, le d-gamma-tocophérol est spécifiquement actif pour neutraliser le peroxinitrite (10), ce qui s’explique stériquement par l’absence de groupe méthyle en position vicinale du groupe hydroxyle, offrant ainsi plus d’espace à son action.
Ceci pointe aussi l’importance d’utiliser de la vitamine E naturelle au lieu de la mono molécule dl-alpha-tocophérol qui est un produit racémique obtenu par synthèse et qui est couramment présenté sur le marché pharmaceutique comme la vitamine E. Bien qu’étant le plus largement prescrit, ce produit synthétique est biologiquement moins actif que le produit naturel car composé pour moitié de l’énantiomère «l» qui n’a pas d’utilité physiologique reconnue et est doté d’une biodisponibilité significativement plus faible (11).
Résultats expérimentaux des effets de la vitamine E sur la barrière hémato-encéphalique
Les effets protecteurs de la vitamine E sur la BHE ont été montrés chez le rat âgé en état de convulsions provoquées par le pentylènetétrazol (12).
Ce modèle d’épilepsie expérimentale comporte une composante pathologique sous forme d’augmentation considérable de la perméabilité de la BHE.
Il a été montré que cette augmentation était significativement réduite par la vitamine E.
Ces résultats apportent une preuve que la vitamine E est active sur la BHE dans des conditions provoquant sa rupture.
Perspectives cliniques
Si d’un point de vue clinique la vieillesse n’est pas considérée comme une maladie, les dérèglements qui l’accompagnent au niveau cérébral peuvent se manifester d’abord par des troubles cognitifs légers, pouvant s’aggraver jusqu’à devenir pathologiques. Plusieurs pathologies neurodégénératives sont associées à un stress oxydatif lequel se manifeste par une peroxydation des lipides, une oxydation des protéines et la présence d’autres marqueurs (13). Parmi les maladies dans la pathogenèse desquelles un stress oxydatif est considéré comme jouant un rôle important se trouvent la maladie d’Alzheimer (MA) et la maladie de Parkinson (MP) (14).
Le cerveau contient des hauts niveaux de lipides oxydables qui doivent être protégés par des antioxydants. Des concentrations faibles de vitamine E, quantitativement l’antioxydant lipophile majeur dans le cerveau, ont été fréquemment observées dans le liquide cérébrospinal de patients MA, suggérant qu’un traitement avec des compléments alimentaires pourrait retarder le développement de la MA (15).
Ce concept est en accord avec les résultats d’une étude clinique contrôlée avec placebo, effectuée avec de la vitamine E (2000 UI, pendant 2 ans) et montrant un ralenti (-53%) de la détérioration fonctionnelle de patients atteints de MA modérée (16).
A ce jour, de nombreuses études cliniques ont été effectuées avec la vitamine E sur les maladies neurodégénératives avec des résultats controversés. Ces variations sont explicables par les différences de durée de traitement, courtes dans le cas d’études cliniques, longues dans le cas d’observation des effets de la vitamine E alimentaire ou en compléments, ainsi que par les doses administrées. Par exemple dans une étude sur patients MA (17) la taille de l’échantillon était très petite et la dose de vitamine E comportait 800 UI)/jour pendant une durée de 6 mois alors que dans d’autres études les doses étaient 2000 UI en prise quotidienne pendant 2 ou 3 ans.
Les différences entre les types de vitamine E administrée - racémique, tocophérol monomoléculaire, naturelle – peuvent aussi expliquer les différences de résultat (18) comme, par exemple, celui d’une étude ayant conclu à l’absence de bénéfice de la vitamine E sur le déficit cognitif léger de patients MA. L’analyse de cette étude (19) pointe le fait qu’elle examine les effets d’un complément composé uniquement d’alpha-tocophérol, dont le gamma-tocophérol est donc absent.
Or, le gamma-tocophérol a été trouvé plus efficace dans la capture de radicaux libres et de nitrogènes oxygénés qui sont des composants des pathologies neurodégénératives.
De plus, il est observé que l’usage d’un complément d’alpha-tocophérol peut réduire significativement le taux de gamma-tocophérol physiologique dans le sérum sanguin ceci pouvant entrainer d’importants effets biologiques.
Il en ressort que les effets bénéfiques sur la santé attendus d’un complément d’alpha-tocophérol peuvent être supprimés par des changements délétères dans la biodisponibilité d’autres formes plus actives de tocophérols, cette situation comptant parmi les raisons pouvant expliquer l’absence d’effet d’une supplémentation en alpha-tocophérol sur les troubles cognitifs légers de patients MA.
Une étude a montré que le gamma-tocophérol réduisait plus fortement le stress nitrosatif (c’est à dire relatif au peroxynitrite) dans le cerveau que l’alpha-tocophérol (20).
Dans une autre étude, il s’est avéré qu’une augmentation de la prise d’un mélange de tocophérols à partir de la nourriture allait de pair avec un risque plus faible de problèmes cognitifs que la prise d’alpha-tocophérol seul (21).
En outre, le gamma-tocophérol réduisait le risque de démence Alzheimer plus fort que l’alpha-tocophérol : la prise de 5 mg d’alpha-tocophérol par jour faisait baisser le risque d’Alzheimer de 34 %, celle de gamma-tocophérol de 40%.
Les répercussions des deux tocophérols sur la neuropathologie d’Alzheimer sont complexes, mais le gamma-tocophérol semble y jouer un rôle déterminant.
Un traitement de la maladie de Parkinson par la vitamine E fait l’objet d’intérêt depuis de nombreuses années. Si, au contraire de la Sélégiline qui est un inhibiteur de la monoamineoxydase (IMAO) la vitamine E s’est montrée inactive chez le rat sur l’activité des neurones dopaminergiques nigrostriataux (22), son mécanisme d’action comme antioxydant a orienté les recherches qui la concernent vers les aspects vasculaires de la MP auxquels il est porté de plus en plus d’attention. Un dysfonctionnement endothélial a été impliqué comme évènement crucial de plusieurs troubles du système nerveux central, dont la maladie de Parkinson (23). Une étude clinique en double aveugle a montré que la vitamine E, associée à l’oméga-3, améliorait significativement tous les paramètres d’évaluation de sévérité de la maladie de Parkinson (24).
En rapport avec l’objet du présent article, il a été montré que la barrière-hémato-encéphalique présentait des ruptures dans les régions du cerveau impliquées dans la pathophysiologie de la maladie de Parkinson (25). Cette constatation suggère une approche thérapeutique possible par la vitamine E, en tenant compte des conditions spécifiées pour la maladie d’Alzheimer.
Conclusion
Les effets des micro-ondes chez l’animal présentent des caractéristiques répondant à la description d’une détérioration de la fonction cérébrale. Appliqués à l’homme âgé, ils s’identifient aux symptômes d’un vieillissement. Ces observations sont expliquées par les conséquences au niveau neuronal de l’augmentation de la rupture progressive de la barrière-hémato-encéphalique.
Une perspective de traitement par la vitamine E naturelle est suggérée en rapport avec les propriétés antioxydantes spécifiques de son composant d-gamma-tocophérol sur le mécanisme d’ouverture de la BHE, pouvant ralentir les troubles de la sénescence à leur début.
Références
(1) Costa e Silva J. Vieillissement cérébral, aspects biologiques et psychosociaux. Académie Nationale de Médecine, Communication scientifique, Séance du 11 octobre 2005
(2) Brown R., Lockwood A., Sonawane B. Neurodegenerative Diseases: An Overview of Environmental Risk Factors. Environmental Health Perspectives 2005; 113(9): 1250-1256
(3) Jun Tang, Yuan Zhang, Liming Yang et al. Exposure to 900 MHz electromagnetic fields activates the mkp-1/ERK pathway and causes blood-brain barrier damage and cognitive impairment in rats. Brain Research 2015; 1601: 92-101
(4) Eberhardt J., Bertil R., Person R. et al. Blood-brain barrier permeability and Nerve cell damage in rat brain 14 and 28 days after exposure to microwaves from GSM mobile phones .Electromagnetic Biology and Medicine 2008; 27(3): 215-229
(5) Adang D., Remacle C., Vander Vorst A. Results of a long-term low-level microwave exposure of rats IEE Transactions on Microwave Theory and Techniques 2009; 57(10): 2488-2497
(6) Adang D., Campo B., Vander Vorst A. Has a 970 MHz pulsed exposure an effect on the memory related behavior of rats? Proceedings of the 9th European Conference in Wireless Technology, 2-9600551-5-2 C 2006 EuMA, September 2006, Manchester UK, pp.135-13
7) Van de Haar H., Burgmans S., Jansen J. et al. Blood-Brain Barrier Leakage in Patients with early Alzheimer Disease. Radiology 2016; 281(2): 527-535
(8) Suofu Y. et al., Peroxynitrite decomposition catalyst prevents MMP activation and neurovascular injury after prolonged cerebral ischemia in rats. J Neurochem. 2010; 115(5): 1266-1276
(9) Rempe R. G., Hatz A. M. S., Bauer B., Matrix metalloproteinases in the brain and blood-brain barrier: Versatile breakers and makers. J Cereb Blood Flow Metab. 2016; 36(9): 1481-1507
(10) Traber M.G., Utilization of Vitamin E. Biofactors (Oxford, England), 01 Jan 1999; 10(2-3): 115-120
(11) Jiang Q. et al. Gamma tocopherol, the major form of vitamin E in the US diet, deserves more attention. Am J Clin Nut. 2001; 74: 714-22
(12) Yorulmaz H., Seker F.B., Oztas B. Effect of Vitamin E on Blood-Brain Barrier Permeability in Aged Rats with PTZ-Induced Convulsions. Neurophysiology 2011; 42: 349-353
(13) Markesbery W., Carney J. Oxidative alterations in Alzheimer’s disease. Brain Pathology. 1999; 9(1): 133-146
(14) Butterfield A., Castagna A., Drake J. Vitamin E and neurodegenerative disorders associated with oxidative stress. Nutritional Neuroscience 2002; 5(4): 229-239
(15) Kontush A. et Schekatolina S. Vitamin E in Neurodegenerative disorders: Alzheimer’s disease. Annals of the New York Academy of Sciences 2004; 1031(1): 249-262
(16) Sano M., Ernesto Ch., Thomas R. et al. A controlled trial of Selegiline,alpha-tocopherol,or both as treatment for Alzheimer’s disease. N Engl J Med. 1997; 336: 1216-22
(17) Lloret A., Badia MC., Mora N. et al. Vitamin E paradox in Alzheimer’s disease: It does not prevent loss of cognition and may even be detrimental. J Alzheimers Dis. 2009; 17(1): 143-149
(18) Brewer G. Why vitamin E therapy fails for treatment of Alzheimer disease. J Alzheimers Dis. 2010; 19(1): 27-30
(19) Owoedimo B., Ugoro & Shaker A., Mousa. Vitamin E forms in Alzheimer’s disease: a review of controversial and clinical experiences. Critical Reviews in Food Science and Nutrition 2010; 50(5): 414-419
(20) Williamson K., Gabbita S., Mou S. et al. The nitration product 5-nitro-gamma-tocopherol is increased in the Alzheimer Brain. Nitric Oxide. 2002; 6(2): 221-227
(21) Morris M., Evans D., Bienas J. et al. Vitamin E and cognitive decline in older persons. Arch Neurol. 2002; 59(7): 1125-1132
(22) Miklya I., Knoll B., Knoll J. A pharmacological analysis elucidating why, in contrast to (-)-deprenyl (Selegiline), alpha-tocopherol was ineffective in the DATATOP study. Life Sciences 2003; 72(23): 2641-2648
(23) Grammas P., Martinez J., Miller B. Cerebral microvascular endothelium and the pathogenesis of neurodegenerative diseases. Expert Rev.Mol.Med. 2011; 13: e19
(24) Taghizadeh M., Tamtaji O., Dagostar F. et al. The effects of omega-3 fatty acids and vitamin E co-supplementation on clinical and metabolic status in patients with Parkinson’s disease: A randomized, double-blind, placebo-controlled trial. Neurochemistry International 2017; 108: 183-189
(25) Al-Bachari S., Naish J., Parker G. et al. Blood-brain-barrier leakage is increased in Parkinson’s disease. Front.Physiol. 2020; 11: 593026



Aucun commentaire:
Enregistrer un commentaire
Remarque : Seul un membre de ce blog est autorisé à enregistrer un commentaire.